|
Médecine d’Urgence |
Le syndrome coronarien aigu dans le cadre de l’urgence préhospitalière. |
|
P. Goldstein F. Vanheems
|
Correspondance : Dr Patrick Goldstein, SAMU Régional de Lille, CHRU de Lille, 5 avenue Oscar Lambret, 59037 Lille cedex.
Tél : 03 20 44 46 38, Fax : 03 20 44 49 15, Email : pgoldstein@chru-lille.fr
Points essentiels
· La maladie coronarienne est la deuxième cause de mortalité en France avec 120 000 infarctus du myocarde par an et plus de 40 000 décès.
· La fréquence de l'infarctus du myocarde dit typique ou syndrome coronarien aigu (SCA) sus ST diminue alors qu'augmentent les SCA sans augmentation du segment ST (angor instable ou infarctus sans onde Q).
· La réduction de mortalité est de 50 % pour une reperfusion coronaire effectuée la 1ère heure et de 30 % la deuxième heure.
· Le bénéfice de la thrombolyse est d’autant plus marqué qu’elle peut être administrée dans les deux heures qui suivent le début de la douleur. Elle est même en terme d’efficacité dans ce cas supérieure à l’angioplastie.
· L'administration pré-hospitalière des agents thrombolytiques permet une réduction de la mortalité de 17 % et un gain de temps de plus de 45 min par rapport à la thrombolyse intra-hospitalière.
· Le diagnostic est avant tout clinique.
· En présence d’un ECG normal ou sans élévation du segment ST, les marqueurs précoces de l'ischémie myocardique peuvent être des éléments essentiels de l'orientation diagnostique et thérapeutique dès la phase pré-hospitalière.
· La thrombolyse pré-hospitalière est aujourd'hui totalement intégrée comme recommandation de classe IA en l’absence de contre-indication.
· Le choc cardiogénique et les patients âgés ne sont pas des contre-indications à la thrombolyse pré-hospitalière. Par contre, elle n’est pas indiquée au cours des SCA sans élévation du segment ST.
· Thrombolyse et angioplastie sont des techniques non opposables mais complémentaires.
DONNÉES ÉPIDÉMIOLOGIQUES
La maladie coronarienne est la deuxième cause de mortalité en France avec 120 000 infarctus du myocarde par an et plus de 40 000 décès soit près de 9 % incluant les morts subites. Le projet épidémiologique MONICA a permis d'évaluer la fréquence de ces décès d'origine coronaire à 200-260/100 000 habitants [1]. La mortalité cardiovasculaire est de loin la première cause de décès chez l'homme de moins de 65 ans. L'amélioration du pronostic porte essentiellement sur la mortalité hospitalière (5 à 10 %) depuis la généralisation des méthodes de reperfusion coronaire. La maladie coronaire évolue en France comme en Europe en terme de prévalence ces dernières années. La fréquence de l'infarctus du myocarde dit typique ou syndrome coronarien aigu (SCA) avec sus-décalage permanent du segment ST diminue alors qu'augmentent les SCA sans augmentation du segment ST que sont l'angor instable ou l'infarctus sans onde Q [2]. L'activité cardiologique représente en moyenne 20 à 40 % de l'activité des SMUR de France dont plus de 30 % de SCA. L'activité des SMUR en ce domaine ne peut donc se limiter au seul infarctus du myocarde en phase aiguë avec sus-décalage du segment ST mais bien intégrer des stratégies dynamiques de prise en charge des SCA sans augmentation du segment ST. En fait, c'est la définition même de l'infarctus qui évolue pour dépasser le seul diagnostic électrique pour s'étendre au diagnostic biochimique (Fig. 1).
LE TEMPS GAGNÉ. FACTEUR CLÉ DU SUCCÈS.
Le sus-décalage du segment ST signifie une oblitération artérielle aiguë, le plus souvent de nature thrombotique, exigeant la reperfusion coronaire la plus précoce possible. Le gain de survie est d’autant plus important que la reperfusion du myocarde est précoce, complète et durable [3]. La réduction de mortalité est de 50 % pour un traitement effectué la 1ère heure et de 30 % la deuxième heure. La précocité de la reperfusion concerne autant l’angioplastie que la thrombolyse [4-7]. Le bénéfice de la thrombolyse est d’autant plus marqué qu’elle peut être administrée dans les deux heures qui suivent le début de la douleur. Elle est même en terme d’efficacité dans ce cas supérieure à l’angioplastie. Cette administration ultraprécoce de thrombolytiques a permis l’identification d’infarctus « avortés » [8]. Les traitements thrombolytiques par voie intra-veineuse ont donc un rôle essentiel dans cette volonté de reperfusion précoce [9]. L'administration pré-hospitalière des agents thrombolytiques permet une réduction de la mortalité de 17 % [10-12] et un gain de temps de plus de 45 min par rapport à la thrombolyse intra-hospitalière [13]. Il est donc primordial d'intervenir dès l'appel du patient, au plus près de sa douleur. La thrombolyse pré-hospitalière a démontré son innocuité lorsque les contre-indications sont respectées, même chez des personnes âgées et est introduite dans les recommandations internationales [14]. Elle ne peut, cependant, résumer à elle seule le traitement initial de l'infarctus. Au contraire, elle doit s'intégrer dans de réelles stratégies dynamiques de prise en charge associant l'angioplastie à l'utilisation précoce des inhibiteurs des glycoprotéines (GP) IIb/IIIa, à des doses réduites d'héparine non fractionnée ou d'héparine de bas poids moléculaire. La prise en charge du syndrome coronarien en phase aiguë est donc en pleine évolution.
La prise en charge initiale
Les intervenants médicaux
La prise en charge d’un patient présentant un SCA est incontestablement un acte de réanimation pré-hospitalière. Elle ne peut être correctement assurée que par un médecin de l’urgence encadrant une équipe complète de SMUR et disposant d’un ensemble de réanimation adapté directement accessible [15]. L’organisation du travail en équipe est un gage de réussite [16]. En effet, une formation conjointe des médecins et des personnels paramédicaux à la gestion globale des patients permet encore de gagner du temps.
Le diagnostic est avant tout clinique.
La douleur peut être typique, d'allure angineuse, à début brutal, intense, rétrosternale, constrictive en barre avec ou sans irradiation. Elle s'accompagne alors d'une sensation de mort imminente, évolue depuis 30 min et résiste à la prise de dérivés nitrés. Elle est souvent associée à des signes d'accompagnement tels que des troubles digestifs, un malaise général, des sueurs, une pâleur, des lipothymies qui parfois résument la symptomatologie. Mais parfois, la douleur peut être absente (5 à 10 % des cas) en particulier chez le sujet âgé et le sujet diabétique. Les formes atypiques sont fréquentes dans leur topographie, leur intensité ou leur mode de révélation. L'horaire de survenue de la douleur est un élément essentiel à rechercher car déterminant pour la décision thérapeutique. L'interrogatoire recherche les antécédents du patient, une éventuelle histoire coronarienne familiale, les traitements en cours, leur observance ou leur changement récent. Cependant, il convient de remarquer que dans le cadre de l'activité des SMUR, l'infarctus est inaugural dans plus de 50 % des cas. La recherche de facteurs de risque majeurs tels que l'hypercholestérolémie, l'hypertension artérielle, le tabagisme ou le diabète est toujours réalisée car ces facteurs sont autant d'éléments de gravité surajoutés qui interviennent non seulement dans la décision thérapeutique mais également dans l'orientation du patient. La mesure des constantes vitales, l'auscultation démasqueront une éventuelle mauvaise tolérance hémodynamique laissant suspecter un choc cardiogénique et modifiant la prise en charge initiale. Par ailleurs, l'examen clinique tente d'éliminer une autre affection lorsqu'un doute diagnostique subsiste en s'attachant à démasquer tout particulièrement une péricardite ou une dissection aortique. C'est dès cette phase précoce que l'on recherche d'éventuelles contre-indications à la thrombolyse (Tableau I) dans le cadre d'un infarctus bien sûr mais également devant tout SCA dont on connaît le risque d'évolution à court terme vers l'infarctus. Enfin, aujourd'hui chez le sujet jeune la recherche d'une prise récente de cocaïne est recherchée.
Les données de l'électrocardiogramme
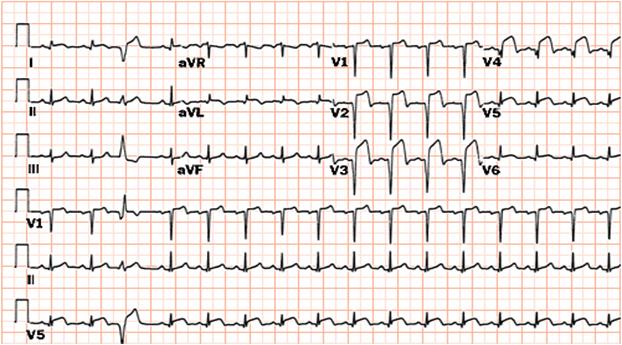
L'électrocardiogramme 17 dérivations est idéalement la clé du diagnostic. Les douze premières dérivations peuvent mettre en évidence un sus-décalage à convexité supérieure du segment ST supérieur à 1 mm dans les dérivations frontales ou à 2 mm dans les dérivations précordiales et ceci dans au moins deux dérivations contiguës (Fig. 2). La présence d'images en miroir dans les dérivations opposées conforte le diagnostic. L'enregistrement doit être complété par l'analyse des dérivations droites (V3R, V4R) à la recherche d'un infarctus du ventricule droit qui modifie la thérapeutique initiale, engage la prudence et conditionne l'orientation. L'analyse des dérivations postérieures (V7, V8, V9) vient compléter la rigueur de l'examen électrique (Tableau II).
En fait, 18 % des électrocardiogrammes sont atypiques et 50 % ne permettent pas de faire le diagnostic. Un authentique infarctus est souvent précédé d'un courant de lésion sous-épicardique, voire d'un ECG normal. Ceci justifie devant une simple présomption clinique de réitérer l'examen électrique à 15 min d'intervalle. L'existence d’un bloc de branche gauche d'apparition récente associée à une douleur typique doit faire suspecter le diagnostic d'infarctus du myocarde (IDM) et faire prendre la décision de revascularisation. Dans tous les cas, la récupération d'un ECG antérieur vient conforter le diagnostic. Dans les cas les plus litigieux, il peut être fait recours à la transmission de l'électrocardiogramme par télémétrie. Cependant, devant une symptomatologie et un tracé typiques, le diagnostic des médecins urgentistes est sûr et leur permet de poser l’indication d'une revascularisation urgente soit par thrombolyse soit par angioplastie primaire. Parfois malgré une douleur évocatrice, les signes électriques restent discrets et non spécifiques voire même résolutifs lors de la phase pré-hospitalière et les signes patents de SCA n'apparaissent que dans les heures suivantes justifiant l'hospitalisation du patient et des contrôles électriques toutes les 6 heures.
Les éléments clinico-électriques de diagnostic sont-ils suffisants
en phase pré-hospitalière ?
La stratification du risque précoce en fonction des seuls événements cliniques ou électriques n'est peut-être aujourd'hui pas suffisamment exhaustive. En pratique, trois situations s'offrent à l'urgentiste :
1 - l'électrocardiogramme est typique avec un sus-décalage du segment ST franc, la décision de reperfusion est immédiate ;
2- l'électrocardiogramme est anormal sans augmentation du segment ST, il peut s'agir d'un véritable infarctus sans onde Q ou d'un angor instable. Il faut donner ici toute son importance à un sous-décalage du segment ST qui, associé à une élévation des marqueurs de la souffrance myocardique et des facteurs de risque, traduit un très mauvais pronostic et impose une stratégie agressive précoce [17, 18] ;
3- l'électrocardiogramme est normal mais la clinique est évocatrice. Les marqueurs précoces de l'ischémie myocardique peuvent être dans les deux derniers cas des éléments essentiels de l'orientation diagnostique et thérapeutique de ces patients et dès la phase pré-hospitalière. Ces marqueurs biologiques ont largement fait leur preuve en milieu hospitalier [19]. La myoglobine, les troponines et les CK-MB sont dosées en routine [17], ont une valeur pronostique dans le cadre des SCA sans élévation du segment ST et contribuent largement à leur stratification [20] et leur orientation thérapeutique (Tableau III). La troponine I est le marqueur le plus spécifique de la nécrose myocardique. Toutefois, sa cinétique d'apparition (> 2 h) semble en limiter l'usage pour la prise en charge précoce des infarctus en phase aiguë mais est probablement essentielle pour juger de la gravité potentielle d'un SCA sans élévation du segment ST. La myoglobine, marqueur plus sensible, d'apparition plus précoce mais moins spécifique pourrait être un élément du triage pré-hospitalier dans les années à venir. La nécrose myocardique "à minima" peut être détectée par l'élévation isolée de la troponine au cours d'un SCA sans sus-décalage permanent du segment ST. C'est bien de la synthèse de ces événements cliniques et biologiques que vient la nouvelle définition des SCA. L'utilisation de ces marqueurs peut se faire grâce à des kits spécifiques au lit du malade et dès la phase pré-hospitalière, ils deviendront bientôt incontournables à la prise en charge moderne des SCA dès la phase pré-hospitalière. Le dosage des marqueurs avant toute thrombolyse peut guider l'évolution thérapeutique car une ascension de cette troponine traduirait un échec de la thrombolyse et imposerait un geste urgent de revascularisation. De plus amples contrôles de qualité et des essais comparatifs de ces mini-laboratoires embarqués sont encore nécessaires. D'autres marqueurs de l'inflammation, comme la CRP ou le Brain Natriuretic Peptide (BNP), pourraient également très rapidement se positionner. A la lumière de ces données, on voit se dessiner de nouveaux algorithmes décisionnels pour l'évaluation et la gestion des syndromes coronariens avec des orientations argumentées vers les centres de cardiologie interventionnelle. Cependant et tout particulièrement dans le cadre du SCA sus-ST, la décision de reperfusion doit être immédiate et ne pas attendre un quelconque résultat biologique.
La thrombolyse intraveineuse a incontestablement été une véritable révolution car elle a permis de réouvrir des artères occluses à grande échelle. La "golden hour" se situe dans les deux heures qui suivent le début des symptômes. La thrombolyse intraveineuse s'est donc imposée comme méthode de référence utilisable par les acteurs de l'urgence au domicile comme dans l'ambulance de réanimation. La thrombolyse pré-hospitalière est aujourd'hui totalement intégrée comme recommandation de classe IA [14], elle est validée jusqu'à la 12ème heure. La méta-analyse de Morrisson et al. permet même de conclure que la thrombolyse intra-hospitalière est un échec stratégique [16].
En France, le TNK-tpA est aujourd’hui l’agent thrombolytique de référence [21]. La tolérance et l’efficacité clinique et angiographique du TNK-tpA ont été évaluées avec succès [22]. L’intérêt de l’association TNK-tpA à l’énoxaparine a été clairement démontré dans le cadre de l’essai ASSENT 3 [23]. Cependant, cet essai multicentrique international ne concerne que la thrombolyse intra-hospitalière. L’essai ASSENT 3+ [13] concerne 1600 patients pris en charge dans les conditions de l’urgence pré-hospitalière. Dans cet essai, l’association TNK-tpA-énoxaparine se traduit par une augmentation du risque hémorragique intracérébral chez les patients de plus de 75 ans et chez les femmes. Dans ce cas, l’association à l’héparine non fractionnée est préférable.
La thrombolyse pré-hospitalière ne se conçoit qu'avec un respect absolu des indications et des contre-indications. Le choc cardiogénique et les patients âgés ne sont pas des contre-indications. Bien évidemment, la thrombolyse pré-hospitalière ne s’adresse pas aux SCA sans élévation du segment ST.
L'angioplastie de première intention est la décision de choix dès lors que le délai entre le début de la douleur et le traitement est supérieur à 2 heures et que le délai premier intervenant médical-inflation est inférieur à 90 minutes. Dans ce cadre l’administration pré-hospitalière d’Abciximab avant l’angioplastie avec stent présente un intérêt affirmé par rapport à une administration plus tardive d’Abciximab [24].
L'association des anti-glycoprotéines IIb/IIIa à des doses réduites de fibrinolytiques se traduit par une augmentation du risque hémorragique [23] et ne peut donc aujourd’hui être proposée. Cependant, des études de sous-population de sujets jeunes présentant des infarctus étendus ne ferment pas définitivement la porte à ces associations et méritent des investigations ultérieures [25].
Thrombolyse pré-hospitalière ou angioplastie primaire ? Le faux débat.
Toutes les études randomisées comparant angioplastie primaire et thrombolyse montrent la supériorité de la première par rapport à la seconde en terme de morbi-mortalité hospitalière et de risque de ré-infarctus [26, 27]. Cependant, ces études n’intègrent, en dehors de l’essai CAPTIM, que des thrombolyses intra-hospitalières.
L’essai français CAPTIM compare dans une étude randomisée multicentrique, l’angioplastie et la thrombolyse pré-hospitalière [28]. Il n’y a aucune différence dans l’analyse combinée de critères associant mortalité à 30 jours, ré-infarctus et AVC. L’élément essentiel de cette étude réside probablement dans le nombre important de patients thrombolysés ayant bénéficié d’une angioplastie (33 %). L’association des deux techniques permet d’observer le plus faible taux de mortalité à J30 relevé dans les études les plus récentes portant sur les techniques de reperfusion en urgence dans le cadre de l’infarctus du myocarde, y compris, les études de transfert direct vers un centre d'angioplastie [29]. Ces études n’abordent jamais l’association thrombolyse et angioplastie qui apparaissent bien comme des techniques non opposables mais bien complémentaires [30-33].
L’analyse de CAPTIM à un an permet de dessiner ce qui pourrait faire office de recommandations [6]. En effet, dès lors que la thrombolyse pré-hospitalière peut être administrée dans les deux heures qui suivent le début de la douleur, les résultats en terme de mortalité et d’occurrence du choc cardiogénique, bien que non significatifs, sont en faveur du bras thrombolyse. Au-delà de ces études, l’analyse du registre USIC 2000 confirme l’intérêt de ces stratégies combinées associant thrombolyse et angioplastie [34].
Les traitements conventionnels.
L'oxygénothérapie n'est pas systématique. Elle est par contre hautement recommandée dès qu'il existe des signes de décompensation cardiaque ou que la saturation artérielle est inférieure à 90 %.
L'analgésie est systématique, c'est une priorité thérapeutique car l'hyperadrénergie est toujours délétère. Elle fait largement appel à la morphine titrée après évaluation de la douleur par une échelle visuelle analogique. Un complément anxiolytique peut être utile, surtout dans le cadre de l'urgence pré-hospitalière. Les dérivés nitrés n'apportent aucun bénéfice au cours de l'infarctus du myocarde non compliqué si ce n'est la diminution de la douleur. L'utilisation systématique de dérivés nitrés en dehors du test diagnostique peut donc être discuté. Ils ne peuvent être utilisés qu'à débit constant et adapté au profil hémodynamique. L'infarctus du ventricule droit et/ou une pression artérielle systolique inférieure à 100 mmHg sont des contre-indications absolues. Par contre la persistance de la douleur et bien entendu un œdème pulmonaire à profil hémodynamique conservé sont des indications pertinentes.
L'aspirine fait partie du traitement de base de la maladie coronaire aiguë. Administrée en pré-hospitalier, elle améliore le pronostic. Dans le cadre des SCA, des doses de 160 à 320 mg réduisent le risque d'évolution vers l'infarctus du myocarde. Elle pourrait être remplacée par le clopidogrel ou associé à celui-ci [35, 36]. Une étude récente a démontré un effet bénéfique de l’association aspirine et clopidogrel au traitement fibrinolytique au cours du SCA avec sus-décalage permanent du segment ST [37].
L'héparinothérapie par voie intraveineuse est systématique dès lors qu'il y a thrombolyse mais les doses utilisées sont réduites et adaptées au poids, soit un bolus de 60 UI.kg-1.h-1 avec un maximum de 4000 UI puis une perfusion intraveineuse de 12 UI.kg-1.h-1 sans jamais dépasser 1000 UI.h-1. Les héparines de bas poids moléculaires sont en cours de validation dans l'infarctus du myocarde en phase aiguë ; elles ont, par contre, montré leur supériorité en terme de diminution de la mortalité mais également de risque de nécrose pour les angor instables [38, 39]. Si dans ce cadre, les HBPM apparaissent comme un progrès significatif en raison de leur simplicité d'utilisation, elles font également courir un risque hémorragique réel parfois sous-estimé. Certaines précautions d'emploi doivent être absolument respectées chez les patients à risque (> 75 ans, insuffisant rénal) et plus particulièrement lors d'associations médicamenteuses actuellement encouragées (anti-GP IIb/IIIa). L’énoxaparine est la seule héparine de bas poids moléculaire à avoir clairement démontré sa supériorité sur l’héparine non fractionnée dans le cadre des SCA.
Certains médicaments sont d'usage discuté en réanimation pré-hospitalière. Les b-bloquants sont indiscutablement indiqués dès le début de la prise en charge intra-hospitalière. Par contre, leur emploi systématique en pré-hospitalier est moins légitime. Ils peuvent cependant être proposés lors du traitement d'éventuels troubles du rythme ou pour la prise en charge d'une hypertension artérielle sévère. L'emploi systématique de la lidocaïne n'est pas indiqué. Elle est à réserver au traitement des arythmies ventriculaires. Certains médicaments ne présentent aucun intérêt dans le cadre de l'urgence pré-hospitalière. C'est le cas du magnésium et des inhibiteurs de l'enzyme de conversion.
LES SYNDROMES CORONARIENS NON ST+
Les efforts doivent également se porter sur les syndromes coronariens sans élévation du segment ST. Comme pour les véritables infarctus avec élévation du segment ST, des scores de risque ont été établis. Le risque de mortalité ou d’infarctus pour ces patients est élevé à un mois et ils doivent donc être identifiés comme à risque dès lors qu’ils sont pris en charge dans le cadre de l’urgence pré-hospitalière.
Cette identification peut de faire sur des éléments électrocardiograhiques : sous-décalage du segment ST ou inversion de l’onde T ; et/ou des arguments cliniques : douleur persistante, troubles du rythme, instabilité hémodynamique, diabète, antécédent coronarien sévère [17]. L’association d’un sous-décalage du segment ST à un ou plusieurs éléments cliniques permet d’identifier ce patient comme à très haut risque sans exiger en phase pré-hospitalière un dosage de troponine. Ces patients doivent bénéficier immédiatement d’un traitement basique (aspirine, antalgique incluant la trinitrine, héparine, b-bloquant) auquel il faut associer le clopidogrel en dose de charge [36] et probablement un inhibiteur des GP IIb/IIIa. Ces patients doivent être adressés par le SMUR après régulation vers une Unité de Soins Intensifs Cardiologiques permettant une coronarographie au mieux en moins de 2h30 et en tout cas dans les 48 heures.
ÉVALUATION DES STRATÉGIES [40]
Les dernières années ont vu la constitution de grands registres nationaux et internationaux. Il existe une grande variété de registres allant de la simple enquête multicentrique sur les pratiques médicales jusqu’à des registres exhaustifs fondés sur la population avec audit des données et contrôle de qualité. La France a bien contribué à la collection de ces registres dont certains tels le registre USIC fait figure de référence internationale. Ces registres issus du monde de la cardiologie (USIC) ou du monde de l’urgence (E-MUST, ESTIM) ont incontestablement permis au-delà de l’analyse une évolution des pratiques cliniques et une augmentation du nombre de patients reperfusés en France. C’est en cela qu’ils sont indispensables. Le problème essentiel pour la prise en charge des SCA reste une proportion trop importante de malades non reperfusés. Aujourd’hui, encore plus que d’opposer la thrombolyse à l’angioplastie, les efforts doivent porter sur les exclus de la reperfusion. L’appel prioritaire au SAMU-Centre 15 dans le cas d’une douleur thoracique est un véritable message de santé publique et la comparaison internationale laisse le champ à de réels progrès encore à faire en France pour gagner encore du temps entre la douleur et la reperfusion [33].
RÉFÉRENCES
1. Tunsdall-Pedoe H, Kuuslasmaa K, Amouyel P. Myocardial infarction and coronary deaths in the World Health Organization-Monica project. Circulation 1994 ; 90 : 583-612.
2. Fox KAA, Cokkinos DV, Deckers J, et al. On the behalf of the ENAC (European Network for Acute Coronary Treatment) Investigators. The ENACT study: a pan-european survey of acute coronary syndromes. Eur. Heart Journal 2000 ; 21 : 1440-49.
3. Dracup K, Alonzo AA, Atkins JM, et al. The physician's role in minimizing prehospital delay in patients at high risk for acute myocardial infarction: recommandation from the National Heart Attack Alert Program. Ann Intern Med 1997 ; 126 : 645-51.
4. Van de Werf F, Ardissino D, Betriu A, et al. Management of acute myocardial infarction with ST segment elevation. The TASK force on the management of acute myocardial infarction of the European Society of Cardiology. Eur Heart J 2003 ; 24 : 28-66.
5. De Luca G, van t’Hof AW, de Boer MJ, et al. Time to treatment significantly affects the extent of ST-segment resolution and myocardial flush in patients with acute myocardial infarction treated by primary angioplasty. Eur Heart J 2004 ; 25 : 1009-13.
6. Steg PG, Bonnefoy E, Chahaud S, et al. for the CAPTIM investigators. Impact of time to treatment on mortality after prehospital fibrinolysis or primary angioplasty. Data from the CAPTIM randomized clinical trial. Circulation 2003 ; 108 : 2851-6.
7. De Luca G, Suryapranata H, Ottervanger JP, Antman EM. Time delay to treatment and mortality in primary angioplasty for acute myocardial infarction. Every minute of delay counts. Circulation 2004 ; 109 : 1223-5.
8. Taher T, Fu Y, Wagner G, et al. Aborted myocardial infarction in patients with ST-segment elevation. J Am Coll Cardiol 2004 ; 44 : 38-43.
9. Newby LK, Rutsch WR, Califf RM, et al. for the Gusto-1 investigators. Time from symptom onset to treatment and outcomes after thrombolytic therapy. J Am Coll Cardiol 1996 ; 27 : 1646-55.
10. Stern R, Arntz HR. Prehospital thrombolysis in acute myocardial. Eur J Med 1998 ; 5 : 471-9.
11. The European Myocardial Infarction Project Group. Prehospital thrombolytic therapy in patients with suspected acute myocardial infarction. N Engl J Med 1993 ; 329 : 383-9.
12. The Task Force on management of acute myocardial infarction of the European Society of Cardiology. Acute Myocardial Infarction: prehospital and hospital management. Eur Heart J 1996 ; 17 : 43-63.
13. Wallentin L, Goldstein P, Amstrong PW, et al. Efficacy and safety of tenecteplase in combination with the low-molecular weight heparin enoxaparin and the unfractioned heparin in the prehospital setting. The ASSENT-3 PLUS randomized trial. Circulation 2003 ; 108 : 135-42.
14. Antman EM, Ande DT, Amstrong PW, et al. ACC/HHA guidelines update for the management of patients with ST-segment elevation myocardial infarction (STEMI), 2004. A report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines. Available at www.acc.org/clinical/guidelines/stemi/index.pdf. Accessed June 9th, 2004.
15. Recommendations of a task force of the European Society of Cardiology and the European Resuscitation council on the prehospital management of acute heart attacks. Resuscitation 1998 ; 38 : 73-9.
16. Morrisson LJ, Verbeek PR, Mc Donald AC, et al. Mortality and pre hospital thrombolysis for acute myocardial infarction. A Meta-analysis. JAMA 2000 ; 283 : 2686-92.
17. Bertrand ME, Simoons ML, Fox K, et al. Management of acute coronary syndromes in patients presenting without persistent ST segment elevation. The Task Force on the management of acute coronary syndromes of the European Society of Cardiology. Eur Heart J 2002 ; 23 : 1809-40.
18. Mega J, Marrow D, Lemos J, et al. B-type natriuretic peptide at presentation and prognosis in patients with ST segment elevation myocardial infarction. J Am Coll Cardiol 2004 ; 44 : 335-9.
19. Jurlander B, Clemmensen P, Wagner GS, Grande P. Very early diagnosis and risk stratification of patients admitted with suspected acute myocardial by the combined evaluation of a single serum value of cardiac troponin I and creatine kinase MB. Eur Heart J 2000 ; 21 : 382-9.
20. Hamm CW, Braunwald A. Classification of unstable angina revisited. Circulation 2000; 102 : 118-22.
21. Wallentin LC. Reducing time to treatment in acute myocardial infarction. Eur J Emerg Med 2000 ; 7 : 217-27.
22. Van de Werf F, Barron HV, Armstrong PW, et al. ASSENT-2 Investigators. Assessment of the Safety and Efficacy of a New Thrombolytic. Incidence and predictors of bleeding events after fibrinolytic therapy with fibrin-specific agents: a comparison of TNK-tPA and rt-PA. Eur Heart J 2001 ; 22 : 2253–61.
23. The Assessment of the Safety and Efficacy of a New Thrombolytic Agent-3 (ASSENT-3) investigators. Efficacy and safety of tenecteplase in combination with enoxaparin, abciximab or unfractionated heparin: the ASSENT-3 randomised trial in acute myocardial infarction. Lancet 2001 ; 358 : 605–13.
24. Montalescot G, Barragan P, Wittenberg O, et al. Abciximab associated with primary angioplasty and stenting in acute myocardial infarction. The ADMIRAL study, 30 day final results. Circulation 1999 ; 100 : 79-87.
25. Savonitto S, Armstrong PW, Lincoff FI, et al. Risk of intracranial haemorrhage with combined fibrinolytic and glycoprotein IIb/IIIa inhibitor therapy in acute myocardial infarction. Dichotomous response as a function of age in the GUSTO V trial. Eur Heart J 2003 ; 24 : 1807-14.
26. Dalby M, Bouzamondo A, Lechat P, Montalescot G. Transfer for primary angioplasty versus immediate thrombolysis in acute myocardial infarction. A meta-analysis. Circulation 2003 ; 108 : 1809-14.
27. Keeley EC, Boma JA, Grines CL. Primary angioplasty versus intravenous thrombolytic therapy for acute myocardial infarction: a quantitative review of 23 randomised trials. Lancet 2003 ; 361 : 13-20.
28. Bonnefoy E, Lapostolle F, Leizorovicz A, et al. Primary angioplasty versus prehospital fibrinolysis in acute myocardial infarction: a randomised study. Lancet 2002 ; 360 : 825-9.
29. Andersen HR, Nielsen TT, Ramussen K, et al. A comparison of coronary angioplasty with fibrinoltyic therapy in acute myocardial infarction (DANAMI-2). N Engl J Med 2003 ; 349 : 733-42.
30. Juliard JM, Himbert D, Cristofini P, et al. A matched comparison of the combination of prehospital thrombolysis and rescue angioplasty with primary angioplasty. Am J Cardiol 1999 ; 83: 305-10.
31. Fernandez-Aviles F, Alonso JJ, Castro-Beiras A, et al. Primary optimal PCI versus facilitated intervention (tenecteplase plus stenting) in patient with ST elevated acute myocardial infarction. The GRACIA-2 randomised trial. Circulation 2003 ; 108 : 468.
32. Scheller B, Hennen B, Hammer B, et al. Beneficial effects of immediate stenting after thrombolysis in acute myocardial infarction. J Am Coll Cardiol 2003 ; 42 : 634-41.
33. Welsh R, Goldstein P, Adgey J, et al. Variations in prehospital fibrinolysis process of care: insights from the ASSENT-3 + prehospital care survey. Eur J Emerg Med 2004 ; 11 : 134-40.
34. Danchin N, Blanchard D, Steg G, et al. Impact of prehospital thrombolysis for acute myocardial infarction on 1-year outcome. Results from the French nationwide USIC 2000 registry. Circulation 2004 ; 110 : 1909-15.
35. Yusuf S, Zhao F, Mehta SR, et al.. Effects of clopidogrel in addition to aspirin in patients with acute coronary syndromes without ST segment elevation. N Engl J Med 2001 ; 345 : 494-502.
36. Peters RSG, Mehta SR, Fox K, et al. Effects of aspirin dose when used alone or in combination with clopidogrel in patients with acute coronary syndrome. Observations from the CURE study. Circulation 2003 ; 108 : 1682-7.
37. Sabatine M, Cannon C, Gibson C, et al. Addition of clopidogrel to aspirin and fibrinolytic therapy for myocardial infarction with ST-segment elevation. N Engl J Med 2005 ; 352 : 1179-89.
38. Mark DB, Cowper PA, Berkowitz SD, et al. Economic assessment of low-molecular-weight heparin (enoxoparin) versus unfractionated heparin in acute coronary syndrome patients: results from the ESSENCE randomized trial. Circulation 1998 ; 97 : 1702-7.
39. Antam EM. Low molecular weight heparin for acute coronary syndromes: tackling the issues head-on. Am Heart J 2003 ; 146 : 191-3.
40. Danchin N, Demicheli T, Cambon JP. Les registres pour quoi faire ? L’exemple des syndromes coronariens aigus. Ann Cardiol Angeiol 2002 ; 51 : 251-60.
Tableau I. Contre-indications des traitements thrombolytiques d'après les recommandations 2000 de l'American Heart Association.
· Saignement interne actif
· Suspicion de dissection aortique
· Processus néoplasique intra-crânien connu
· AVC ou autre événement cérébro-vasculaire < 1 an
· Hypertension artérielle sévère à la prise en charge (PA > 180/110)
· Antécédents hypertension artérielle sévère
· Antécédents d'AVC ou de toute autre pathologie intra-crânienne
· Traumatisme récent (< 2-4 semaines)
· Chirurgie lourde (< 3 semaines)
· Accident hémorragique récent (< 2-4 semaines)
· Maladie connue de la coagulation ou INR > 2-3
· Grossesse connue
· Antécédent d'allergie ou administration préalable de streptokinase
Tableau II. Localisation des infarctus de myocarde.
ECG |
Sus-décalage ST |
Signes Indirects |
Artère Occluse |
|
Antérieur
Etendu |
DI, aVL V1 à V5-V6
|
ST < 0DII, DIII, aVF |
Tronc commun (IVA et circonflexe) |
IVA proximale |
|||
|
DI, aVL V2 à V5-V6 Rarement V1 |
ST < 0DII, DIII, aVF |
IVA moyenne |
|
|
Antérieur |
V1 à V4 |
Peu de modification en territoire inférieur |
IVA distale |
|
Latéral |
DI, aVL V4 à V6 +/- DII, DIII, aVF |
ST < 0 en V1 à V4 R > S en V1 ou V2 |
Circonflexe dominante |
|
DI, aVL V5-V6, V7-V8-V9 |
- ST < 0 en DII, DIII, aVF |
Branche marginale de la circonflexe |
|
|
Inférieur |
DII, DIII, aVF |
ST <0 en DI, aVL en V1 à V4 |
Coronaire droite distale peu développée ou branche coronaire droite |
|
Postéro-latéral |
DII, DIII, aVF V5, V6 V3R, V4R |
ST < 0 en DI, aVL en V1 à V4 R > S en V1, V2 |
Coronaire droite proximale très développée |
|
Postérieur |
V3R, V4R |
R > S en V1, V2 ST < 0 V1 à V3-V4 |
Circonflexe et/ou branche marginale de la coronaire droite |
|
Ventricule droit
|
V3R, V4R |
|
Coronaire droite proximale
|
Tableau III. Cinétique des marqueurs de l’ischémie coronarienne.
|
|
CPK |
CPK MB |
MYOGLOGINE |
TROPONINE I |
|
Délai début d’élévation |
3 - 12h |
3 -12 h |
1 - 4 h |
3 -12 h |
|
Délai du pic |
24 h |
24 h |
6 - 7 h |
3 - 12 h |
|
Délai de normalisation |
48 h |
48 h |
24 h |
5 à 10 j |
|
Spécificité |
|
Proche de 95 % |
80 à 90% |
Proche de 100 % |
Dans un délai de 4 à 6 heures après le début des symptômes, les dosages enzymatiques restent le plus souvent dans les limites de la normale. La répétition des dosages à 2 ou 4 heures d’intervalle est indispensable avant de confirmer la normalité des valeurs.
Seule la troponine (I ou T) est spécifique de la nécrose myocardique.
En raison de son apparition retardée dans le sérum, la troponine offre un intérêt supplémentaire : elle permet de poser un diagnostic rétrospectif, à distance de l’épisode initial.
L’élévation de la troponine peut également être observée au cours de l’insuffisance rénale chronique et de l’embolie pulmonaire aiguë.

IDM = infarctus du myocarde.
Figure 2. Infarctus antérieur vu à la 1ère heure.